introduzione
Originariamente si pensava che l’idrogeno molecolare (H 2 ) si comportasse come un gas inerte nelle cellule dei mammiferi; tuttavia, i nostri studi precedenti hanno dimostrato che questo non è sempre il caso 1 , dimostrando che l’H 2 neutralizza il radicale idrossile (·OH) e il perossinitrito (ONOO – ) all’interno delle cellule e agisce come un nuovo antiossidante per proteggere le cellule dallo stress ossidativo 1 , 2 . L’inalazione di gas H 2 all’1%–4% (v/v) è efficace per il trattamento delle lesioni da ischemia/riperfusione 1 , 3 , 4 . Recentemente, è stato dimostrato che l’inalazione di gas H 2 all’1,3% da un gas premiscelato protegge i neuroni in un modello di arresto cardiaco 5 . Tuttavia, il meccanismo con cui una concentrazione così bassa di H 2 esercita gli effetti positivi non è noto.
Numerosi studi hanno fortemente suggerito che l’H 2 ha il potenziale per una varietà di applicazioni terapeutiche e preventive 6 , 7 . Oltre a estesi esperimenti sugli animali, sono stati riportati più di 10 studi clinici che hanno esaminato l’efficacia dell’H 2 6 , 7 , compresi studi clinici in doppio cieco su pazienti con malattia di Parkinson e reumatismi 8 , 9 . Sulla base di questi studi, il campo della medicina dell’idrogeno è in rapida crescita.
Successivamente, è stato dimostrato che l’H 2 esibisce molteplici funzioni, tra cui attività antinfiammatorie, antiapoptotiche, antiallergiche e antiossidanti, nonché regolazione della differenziazione e del metabolismo energetico 6 , 7 . Per esercitare molteplici funzioni oltre ai ruoli antiossidanti, l’H 2 regola varie vie di trasduzione del segnale e l’espressione di molti geni 6 , 7 . Ad esempio, l’H 2 protegge le cellule neurali e stimola il metabolismo energetico stimolando l’espressione ormonale della grelina 10 e del fattore di crescita dei fibroblasti 21 (FGF21) 11 , rispettivamente. Al contrario, l’H 2 allevia l’infiammazione diminuendo le citochine proinfiammatorie 12 . Tuttavia, è difficile spiegare i meccanismi molecolari attraverso i quali l’H 2 esercita queste funzioni con i soli concetti convenzionali. Per comprendere i meccanismi molecolari attraverso i quali l’H 2 esercita queste molteplici funzioni, è essenziale identificare i bersagli primari dell’H 2 che modulano la trasduzione del segnale e l’espressione genica.
Pertanto, in questo studio, abbiamo mirato a delucidare uno dei meccanismi molecolari mediante i quali l’H 2 media la trasduzione del segnale e l’espressione genica. I nostri risultati suggeriscono che basse concentrazioni di H 2 modulano la trasduzione del segnale di Ca 2+ e regolano l’espressione genica modificando la produzione di specie fosfolipidiche ossidate.
Risultati
H 2 accumulato nelle fasi lipidiche
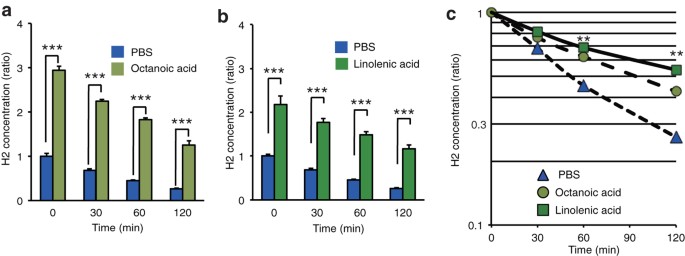
Per comprendere la differenza tra condizioni intracellulari e soluzioni acquose, ci siamo concentrati sulle fasi lipidiche per determinare la localizzazione intracellulare dell’accumulo di H 2 a temperatura ambiente. L’incorporazione di H 2 è stata due o tre volte maggiore nelle fasi liquide di acidi grassi rispetto alla fase acquosa in presenza sia di acqua che di acidi grassi ed è stata trattenuta più a lungo nelle fasi di acidi grassi rispetto alla fase acquosa in recipienti aperti ( Fig. 1a,b ). In particolare, l’H 2 sembrava essere trattenuto significativamente più a lungo negli acidi grassi insaturi (acido linolenico) rispetto agli acidi grassi saturi (acido ottanoico) ( Fig. 1c ), sebbene questa differenza nel tempo di ritenzione potrebbe essere attribuita alla differenza nel tempo di ritenzione. numero di carboni Poiché gli acidi grassi insaturi sono gli obiettivi primari per l’avvio di una reazione a catena dei radicali liberi, abbiamo ipotizzato che l’H2 potesse sopprimere efficacemente questa reazione nelle biomembrane, anche a basse concentrazioni.
Solubilità di H 2 negli acidi grassi in presenza di un solvente acquoso.
La soluzione salina tamponata con fosfato (PBS) satura di H 2 è stata miscelata con lo stesso volume (75 mL) di acido grasso saturo (acido ottanoico) ( a ) o acido grasso insaturo (acido linolenico) ( b ) e mantenuta per 16 ore in una soluzione salina tamponata con fosfato (PBS). sacchetto di alluminio chiuso come descritto in Metodi. Lo stesso volume (3 mL) di ciascuna fase è stato trasferito in ciascuna provetta aperta (ϕ13 mm), seguita dalla misurazione di H 2 al tempo indicato ( n = 4). Gli esperimenti sono stati eseguiti a 25 °C. *** P < 0,001 rispetto a . PBS. ( a , b ) La significatività è stata calcolata utilizzando un test t di Student a due code non accoppiato. ( c ) Andamento temporale dei tempi di ritenzione dell’H 2 in ciascuna fase nei vasi aperti. ** P < 0,01, rispetto a . acido ottanoico ( n = 4).
L’autossidazione degli acidi grassi insaturi è stata soppressa da basse concentrazioni di gas H 2
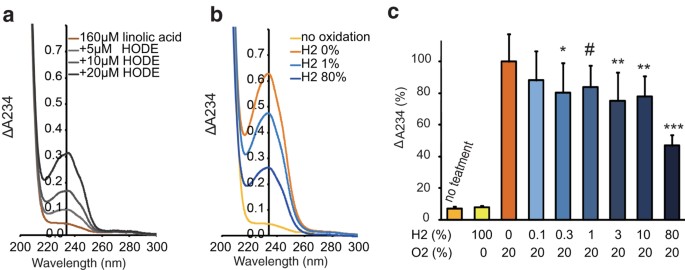
L’autossidazione degli acidi grassi insaturi procede mediante una reazione a catena dei radicali liberi nell’aria 13 . Pertanto, abbiamo misurato l’autossidazione di un acido grasso diinsaturo filmoso (acido linoleico: R-CH = CH-CH 2 -CH = C-R’) a 37 °C per 20 ore al buio in presenza di varie concentrazioni di H2gas . Un diene coniugato, che dovrebbe formarsi per autossidazione, è stato stimato mediante l’assorbimento a 234 nm ( Fig. 2a ). L’assorbimento a 234 nm aumentava a seconda della formazione del diene coniugato [R-CH = CH-CH = CH-CH(-OOH)-R’ o R-CH(-OOH)-CH = CH-CH = CH -R’] accompagnato da perossidazione in un sistema chimico puro (H 2 , O 2 e N 2 sono stati forniti da bombole di gas) ( Fig. 2b ). L’O2 era essenziale per l’autossidazione ( Fig. 2c ). Di conseguenza, anche solo circa l’1% di gas H 2 ha soppresso in modo significativo l’autossidazione dell’acido linoleico a 37 °C, anche in assenza di catalizzatori al buio in un sistema chimico puro ( Fig. 2c ).
Soppressione dell’autossidazione della pellicola di acido linoleico da parte del gas H 2 .
( a ) Profilo dell’assorbimento ultravioletto dell’acido 9-idrossiottadecadienoico; CH 3 (CH 2 ) 4 -CH = CH-CH = CH-CH(-OH)-(CH 2 ) 7 -COOH) (9-HODE) nel cicloesano, mostrato come un diene coniugato standard. ( b ) La pellicola di acido linoleico è stata autoossidata a 37 °C per 20 ore in un tubo di vetro posto in un sacchetto di alluminio chiuso in presenza di varie concentrazioni di H 2 e O 2 come descritto in Metodi. Vengono mostrati i profili rappresentativi dell’assorbimento ultravioletto della soluzione di cicloesano di acido linoleico autoossidato H2 – dipendente. ( c ) Gli acidi linoleici autoossidati con varie concentrazioni di H 2 sono stati valutati misurando l’assorbimento a 234 nm. * P = 0,034 (0,3% H 2 ), # P = 0,069 (1% H 2 ), ** P < 0,01 (3% H 2 , 10% H 2 ) e *** P < 0,001 (80% H 2 ) contro . 0% H2 ( n = 15).
Trasduzione del segnale Ca 2+ mediante ossidazione chimica H 2 -dipendente dei fosfolipidi
I fosfolipidi vengono convertiti in mediatori ossidati che modulano varie vie di trasduzione del segnale non solo mediante reazioni enzimatiche, ma anche mediante ossidazione chimica 14 , 15 . I fosfolipidi ossidati, inclusi 1-palmitoil-2-(5-ossovaleroil)-sn – glicero-3-fosfocolina (POVPC) e 1-palmitoil-2-glutaroil- sn -glicero-3-fosfocolina (PGPC), sono presenti nei processi ossidativi lipoproteine modificate a bassa densità (oxLDL) e sono state riscontrate in lesioni aterosclerotiche 15 . Questi composti sono importanti come induttori di diverse risposte cellulari, tra cui infiammazione, proliferazione e morte cellulare. Inoltre, l’autossidazione della 1-palmitoil-2-arachidonil- sn -glicero-3-fosfocolina (PAPC) porta alla produzione chimica di varie specie di fosfolipidi bioattivi, come POVPC, PGPC, 1-palmitoil-2-(5-idrossi- 8-ossooct-6-enoil)- sn -glicero-3-fosfocolina (HOOA-PC) e acido 5-idrossi-8-osso-6-ottenedioico (HOdiA-PC) 14 , 15 .
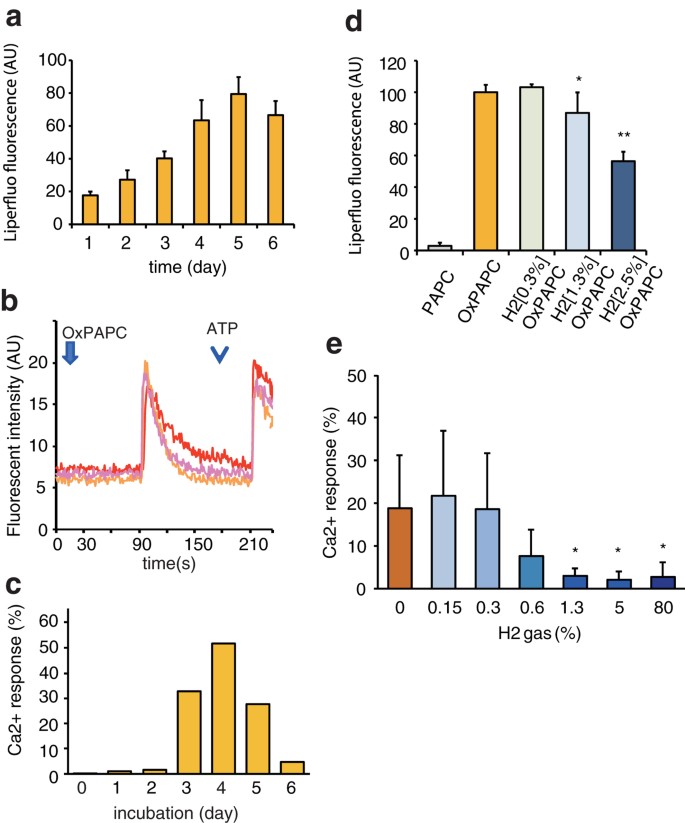
Abbiamo ipotizzato che basse concentrazioni di H 2 possano influenzare alcune reazioni chimiche che portano alla produzione di presunti mediatori lipidici ossidati per la modulazione della trasduzione del segnale. Poiché il PAPC è uno dei principali fosfolipidi nelle biomembrane dei mammiferi, il ruolo dell’H 2 nella produzione chimica dei mediatori fosfolipidici ossidati è stato determinato conducendo l’autossidazione del PAPC puro (con conseguente OxPAPC) in assenza di catalizzatori al buio. La perossidazione del PAPC nell’aria è stata confermata da un aumento del segnale per il colorante fluorescente specifico per i perossidi lipidici, Liperfluo ( Fig. 3a ). Uno studio precedente ha indicato che OxPAPC attiva i fattori di trascrizione coinvolti nella segnalazione del Ca 2+ 16 . Infatti, quando le cellule THP-1 (una linea cellulare monocitica umana derivata da un paziente con leucemia monocitica acuta) sono state esposte a OxPAPC, è stato osservato un aumento transitorio del Ca 2+ cellulare quando un colorante fluorescente sensibile al Ca 2+ , Fluo4-AM è stato utilizzato ( Fig. 3b ). Questa segnalazione di Ca 2+ dipendeva da OxPAPC in modo dipendente dal tempo di ossidazione ( Fig. 3c ).
PAPC autoossidato con segnalazione Ca 2+ modulata con H 2 .
( a ) Il PAPC chimicamente puro è stato autoossidato in aria con umidità del 100% a 25 °C in un sacchetto di alluminio chiuso per i periodi indicati e la produzione dipendente dal tempo di perossidi nell’aria da PAPC chimicamente puro è stata stimata utilizzando la fluorescenza Liperfluo, dove le lunghezze d’onda di eccitazione e l’emissione sono state fissate rispettivamente a 488 e 535 nm, come descritto in Metodi. ( b ) Le risposte rappresentative in THP-1 mediante OxPAPC con l’indicatore fluorescente Ca 2+ Fluo4-AM sono mostrate come descritto in Metodi. La freccia e la punta della freccia indicano rispettivamente l’aggiunta di OxPAPC e ATP. L’ATP (un ligando del canale del Ca 2+ P2X7) è stato utilizzato come controllo positivo. ( c ) Il PAPC è stato autoossidato per i periodi indicati a 25 °C e sottoposto al test di segnalazione del Ca 2+ nelle cellule THP-1. La risposta del Ca 2+ indotta da OxPAPC dipendeva dal periodo di autoossidazione di OxPAPC. ( d ) Il PAPC è stato autoossidato in aria per 3 giorni in assenza o presenza delle concentrazioni indicate di H 2 (H 2 OxPAPC) e il perossido di OxPAPC o H 2 OxPAPC è stato stimato utilizzando Liperfluo come descritto in ( a ) ( n = 3-6). * P = 0,044, ** P < 0,01. ( e ) Il PAPC è stato autoossidato in aria per 3 giorni con le concentrazioni indicate di H2 ( H2OxPAPC ) e quindi sottoposto ad analisi di segnalazione di Ca2 + come descritto in Metodi ( n = 6). * P = 0,021 (1,3% H 2 ), * P = 0,022 (5% H 2 ) e * P = 0,030 (80% H 2 ) rispetto a . niente H2 .
Successivamente, la produzione H2 – dipendente di OxPAPC, che porta all’attivazione della segnalazione di Ca 2+ , è stata studiata autoossidando PAPC per 3 giorni a 25 °C in aria a varie concentrazioni di H 2 (designate come H 2 OxPAPC e la notazione H 2 [x%]OxPAPC è stata utilizzata quando autoossidato in presenza di x% H 2 ). L’H2 ha soppresso la generazione di perossidi totali come rivelato dall’intensità della fluorescenza del Liperfluro ( Fig. 3d ). La segnalazione di Ca 2+ è stata osservata quando il PAPC è stato autoossidato con meno dello 0,3% di H 2 , mentre più dell’1,3% di H 2 ha interrotto significativamente questa segnalazione ( Fig. 3e ).
Per studiare le molecole influenzate da H 2 , abbiamo analizzato H 2 OxPAPC utilizzando la spettrometria di massa il giorno 3 dell’autossidazione. In tutto, sono state rilevate 209 bande, con masse molecolari comprese tra 126,3754 e 991,6494 Da; ciò era coerente con i risultati di un precedente rapporto 15 ( Figura 1 supplementare ). Le differenze nella produzione delle specie H 2 OxPAPC e OxPAPC sono state presentate utilizzando una mappa termica ( Figura 1i supplementare ). I livelli di molte bande aumentavano o diminuivano con differenze nelle concentrazioni di H 2 . Ad esempio, nelle specie relativamente aumentate, i livelli degli induttori di segnalazione Ca 2+ POVPC 16 , HOOA-PC, HOdiA-PC e acido idrossieicosatetraenoico-3-fosfocolina (HETE-PC) 17 erano leggermente aumentati in risposta all’H 2 ( supplementare Figura 1i ).
Poiché è stato segnalato che la forma ridotta di POVPC funziona come un antagonista 18 , è possibile che l’aumento dei livelli della forma ridotta di alcune specie OxPAPC, piuttosto che la diminuzione dei livelli dei presunti agonisti (come POVPC), possa aver interrotto Segnalazione del Ca 2+ come potenziale antagonista. Sono necessari ulteriori studi per identificare il/i mediatore/i bioattivo/i H2 – dipendente/i.
Analisi completa della regolazione H2 – dipendente dell’espressione genica
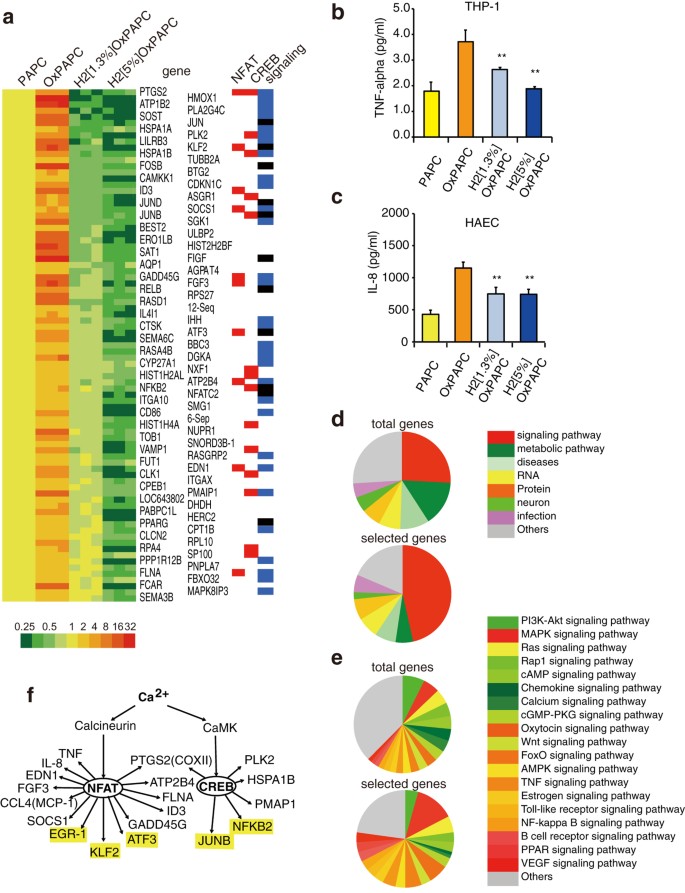
Successivamente, abbiamo studiato come l’H 2 OxPAPC influenza l’espressione genica. Il PAPC è stato autoossidato in assenza o presenza di varie concentrazioni di H2 per 3 giorni e poi somministrato a cellule THP-1 in coltura. In un esperimento preliminare, il cambiamento nel livello di espressione del gene del fattore di necrosi tumorale (TNF)-α in risposta a OxPAPC da quello a H 2 OxPAPC ha raggiunto il picco a 4 ore. Pertanto, utilizzando l’analisi microarray, abbiamo analizzato in modo completo il cambiamento nell’espressione genica in risposta ai mediatori H2 – dipendenti a 4 ore in tre campioni in ciascuna condizione. In totale, 86 geni sono stati selezionati secondo i seguenti criteri, come descritto nella legenda della Fig. 4a : un aumento significativo di OxPAPC ( rispetto a PAPC) e una diminuzione significativa di H 2 [1,3%] OxPAPC e H 2 [5% ]OxPAPC ( rispetto a OxPAPC) ( Tabella supplementare 1 ). Il profilo di espressione genica è stato presentato in una mappa termica ( Fig. 4a ). I geni selezionati sono stati convalidati mediante reazione a catena della polimerasi in tempo reale semiquantitativa (RT-PCR) e sono stati confermati cambiamenti marginali nei livelli di espressione di alcuni geni ( Figura 2 supplementare ).
Cambiamenti nell’espressione genica regolata da H 2 OxPAPC.
( a ) Tre campioni di PAPC, OxPAPC e H 2 OxPAPC sono stati esposti a cellule THP-1 per 4 ore e l’espressione genica è stata analizzata in modo completo utilizzando microarray. Ottantasei geni sono stati selezionati secondo i seguenti criteri; geni sovra-regolati da OxPAPC (più di 2,5 volte, rispetto a PAPC) e quelli down-regolati da H 2 [1,3%]OxPAPC e H 2 [5%]OxPAPC (meno di 0,75 volte e 0,5 volte, rispettivamente , vs . OxPAPC) sono mostrati in una mappa termica (il rosso e il verde indicano rispettivamente la sovraregolazione rispetto al trattamento PAPC e la sottoregolazione rispetto al trattamento OxPAPC, come mostrato nel gradiente di colore). I possibili geni bersaglio di NFAT e CREB sono contrassegnati in rosso a destra. I geni che codificano per i fattori coinvolti nella trasduzione e nella trascrizione del segnale sono indicati rispettivamente in blu e nero a destra. Il rilascio di TNF-α ( b ) (da THP-1) e IL-8 ( c ) (da HAEC) è stato studiato utilizzando ELISA come descritto in Metodi. ( d , superiore) Rapporto tra geni appartenenti a ciascuna categoria per un totale di 7.142 geni identificati dal database KEGG. ( d , inferiore) Rapporto dei geni appartenenti a ciascuna categoria negli 86 geni selezionati elencati in a. ( e , superiore) Rapporto tra geni appartenenti a ciascuna via di segnalazione identificata dall’intero database KEGG. ( c , inferiore) Rapporto tra i geni appartenenti a ciascuna via di segnalazione nei geni selezionati elencati in ( a) . ( f ) L’ espressione H2OxPAPC -dipendente dei geni trascritti da CREB e NFAT. I fattori di trascrizione sono indicati in giallo.
Inoltre, l’espressione regolatoria di TNF-α e IL-8 da parte di H 2 OxPAPC è stata studiata utilizzando THP-1 e un diverso tipo di cellula (cellule endoteliali aortiche umane: HAEC), rispettivamente ( Fig. 4b,c ).
Secondo il database del percorso dell’Enciclopedia dei geni e dei genomi di Kyoto (KEGG) ( http://www.genome.jp/kegg/pathway.html ), sono state identificate e classificate le funzioni di 7.143 geni ( Fig. 4d , in alto). Abbiamo classificato gli 86 geni selezionati ( Fig. 4e , in basso). Di questi 86 geni, il 46,5% apparteneva a quelli coinvolti nelle vie di segnalazione ( Fig. 4d , in alto), mentre il 25,8% del numero totale di 7.143 geni è coinvolto nelle vie di segnalazione ( Fig. 4d , in basso). I geni che codificano i fattori coinvolti nella trasduzione del segnale e nei fattori di trascrizione sono indicati rispettivamente in blu e nero a destra nella mappa termica ( Fig. 4a ).
Tra i geni coinvolti nelle vie di segnalazione, la proporzione di quelli appartenenti alla segnalazione del Ca 2+ era inferiore nei geni selezionati rispetto a quelli dell’intero genoma, indicando che l’H 2 regola meno componenti delle vie di segnalazione del Ca 2+ ( Fig. 4e , inferiore). Ciò era coerente con la scoperta che l’H 2 OxPAPC diminuiva la segnalazione del Ca 2+ . Al contrario, la proporzione di geni appartenenti alla segnalazione della proteina chinasi attivata dal mitogeno (MAPK) era più elevata ( Fig. 4e , in basso), indicando che H 2 regola più componenti delle vie di trasduzione del segnale MAPK ( Fig. 4e , in basso).
Le vie di trasduzione del segnale regolate da H 2 sono mostrate nella Tabella supplementare 1 secondo il database dei percorsi KEGG. Questi dati suggeriscono la possibilità che basse concentrazioni di H2 contribuiscano a varie vie di trasduzione del segnale attraverso specie di fosfolipidi ossidati.
I geni bersaglio della proteina legante l’elemento di risposta cAMP (CREB) sono stati selezionati in base al database dei geni target CREB ( http://natural.salk.edu/CREB/ ) e i geni bersaglio del fattore nucleare delle cellule T attivate (NFAT) sono stati selezionati facendo riferimento a Medline, come mostrato nella Tabella Supplementare 1 . I geni bersaglio di CREB e NFAT sono contrassegnati in rosso a destra nel pannello della mappa termica come NFAT o CREB ( Fig. 4a ). Un numero considerevole dei geni selezionati erano bersagli di CREB o NFAT ( Fig. 4 f ). Questi dati sono coerenti con i risultati di studi precedenti che mostrano la regolazione Ca 2+ -dipendente da parte di questi fattori di trascrizione: CREB viene attivato tramite fosforilazione da una chinasi calmodulina-dipendente (CaMK) 19 in modo Ca 2+ -dipendente e NFAT viene defosforilato mediante calcineurina (CN) in modo Ca 2+ -dipendente, si trasloca nel nucleo e quindi funziona come fattore di trascrizione con le sue proteine partner, ad esempio, la proteina attivatrice 1 (AP-1), CREB, o il fattore nucleare kappa B ( NF-κB) 20 . Infatti, l’esposizione di THP-1 a OxPAPC, ma non a H2OxPAPC , ha stimolato la traslocazione nucleare di NFAT ( Figura 3 supplementare ).
Pertanto, i mediatori ossidati H2 – dipendenti o i presunti antagonisti potrebbero essere associati alla regolazione trascrizionale tramite la segnalazione del Ca2 + .
Gli induttori dei radicali liberi hanno contribuito al percorso NFAT nelle cellule in coltura
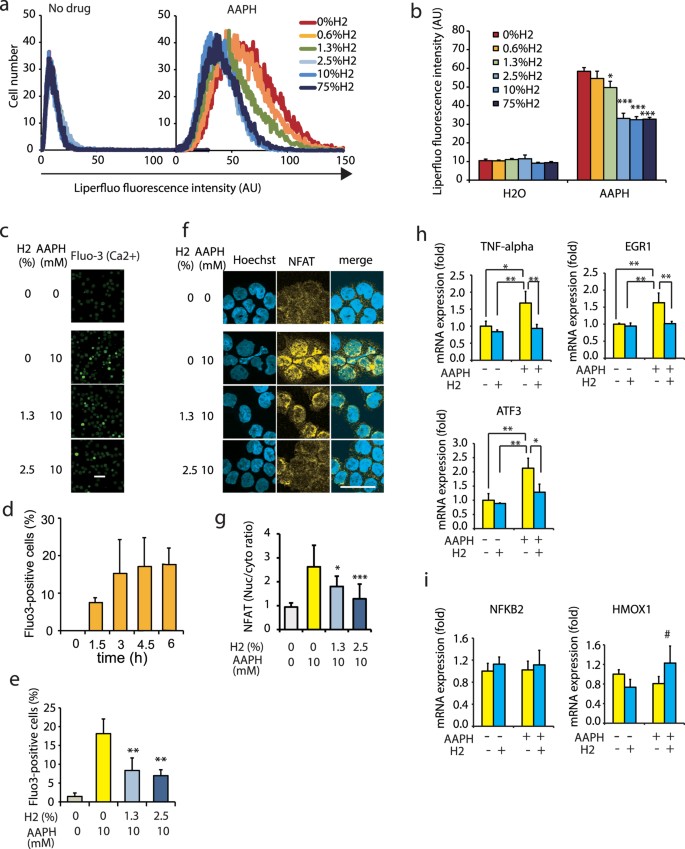
L’autoossidazione degli acidi grassi insaturi, incluso il PAPC, procede mediante una reazione a catena dei radicali liberi 13 e ·OH è l’innesco principale di questa reazione 13 , 21 , 22 . Abbiamo precedentemente dimostrato che l’H 2 riduce i livelli di ·OH all’interno delle cellule in coltura utilizzando il metodo di spin trapping e uno specifico indicatore fluorescente 1 . Pertanto, in questo studio, abbiamo studiato gli effetti dell’H 2 sulla reazione a catena dei radicali liberi dei lipidi utilizzando cellule in coltura. Per avviare una reazione a catena dei radicali liberi all’interno delle cellule, abbiamo utilizzato il 2,2′-azobis(2-metilpropionamidina)dicloridrato (AAPH) 23 , che non è influenzato dall’H 2 ( Figura 4 supplementare ) ed è adatto per la generazione lenta dei radicali liberi mediante una reazione chimica spontanea. La reazione a catena dei radicali liberi dei lipidi porta alla produzione di perossidi lipidici (LPO) 21 , 24 , che possono essere rilevati utilizzando il colorante fluorescente Liperfluo 25 . Pertanto, abbiamo esposto le cellule THP-1 in coltura all’AAPH e stimato la produzione di LPO in base al segnale Liperfluo. Il segnale Liperfluo diminuiva significativamente in presenza di bassi livelli di gas H 2 (ad esempio, 1,3%; Fig. 5a,b ). Pertanto, anche a concentrazioni così basse, l’H2 ha il potenziale di ridurre la generazione di LPO sopprimendo l’inizio e/o la propagazione delle reazioni a catena dei radicali liberi nelle cellule in coltura.
L’H2 ha soppresso la perossidazione degli acidi grassi dipendente dall’induttore dei radicali liberi e la segnalazione di Ca2 + e NFAT.
( a ) THP-1 è stato esposto a un induttore di radicali liberi (10 mM AAPH) in assenza o presenza delle concentrazioni indicate di H2 per 4,5 ore. È stato dimostrato che i profili citometrici a flusso rappresentativi dimostrano i perossidi lipidici con segnali Liperfluo. ( b ) I segnali Liperfluo sono stati quantificati. * P = 0,015, *** P < 0,001 rispetto a . 0% H2 ( n = 6). ( c ) Le cellule THP-1 sono state trattate con AAPH 10 mM per 3 ore in presenza delle concentrazioni indicate di H2 . L’intensità della fluorescenza intracellulare del Fluo-3 è stata osservata utilizzando un microscopio confocale a scansione laser. Barra della scala: 50 μm. ( d ) Le cellule THP-1 sono state trattate con AAPH 10 mM per i periodi indicati in assenza di H 2 e quindi l’aumento dipendente dal tempo del segnale Ca 2+ è stato monitorato mediante l’intensità della fluorescenza intracellulare del Fluo-3 come descritto in ( c ). ( e ) Le cellule Fluo3-positive sono state semi-quantificate dopo il trattamento con AAPH 10 mM per 3 ore in assenza o presenza delle concentrazioni indicate di H 2 . ** P < 0,01 rispetto a nessun H 2 ( n = 3). ( f ) THP-1 è stato trattato con AAPH 10 mM per 3 ore in presenza delle concentrazioni indicate di H2 . La traslocazione di NFAT nel nucleo è stata esaminata come descritto in Metodi e mostrata mediante immunocolorazione in giallo. Il nucleo è stato controcolorato con Hoechst 33342 come mostrato in blu. Barra della scala: 50 μm. ( g ) Le aree che esprimono NFAT sono state semi-quantificate e mostrate dal rapporto tra NFAT nel nucleo e quello nel citosol. * P = 0,023 e ** P < 0,01 rispetto a . nessun H2 ( n = 10). ( h , i ) Le espressioni dei geni bersaglio NFAT ( TNF-α , EGR1 e ATF3 ) ( h ) e dei geni bersaglio non NFAT ( NFKB2 e HMOX1 ) ( i ) sono state stimate utilizzando RT-PCR accoppiata con una sonda TaqMan (le sonde sono elencate nella Tabella supplementare 2 ). I nomi dei geni sono descritti nella Tabella supplementare 1 . * P = 0,015 (per ATF3 ) (+AAPH e +H2 rispetto a +AAPH e –H2 ) . # P = 0,14 (per HMOX1) (+AAPH e –H 2 rispetto a +AAPH e + H 2 ) e ** P < 0,01 ( n = 3)
Successivamente, abbiamo determinato se le risposte indotte dall’H2OxPAPC prodotto chimicamente ( Fig. 3 e 4 ) potevano simulare gli effetti indotti dai radicali liberi nelle cellule in coltura. Quando le cellule THP-1 venivano esposte all’AAPH, i livelli cellulari di Ca 2+ aumentavano ( Fig. 5c ) in modo dipendente dal tempo ( Fig. 5d ), come mostrato dall’analisi di Fluo-3 e la segnalazione di Ca 2+ era soppresso da H 2 ( Fig. 5c,e ). Anche NFAT è stato attivato, come mostrato dalla traslocazione di NFAT nel nucleo ( Fig. 5f,g ) e la traslocazione nucleare di NFAT è stata recuperata da H2 ( Fig . 5f,g ). Inoltre, l’induttore dei radicali liberi ha stimolato l’espressione di alcuni geni bersaglio di NFAT, tra cui TNF-α , proteina 1 di risposta alla crescita precoce ( EGR1 ) e fattore di trascrizione attivante 3 ( ATF3 ), che sono stati mostrati nella Tabella supplementare 1 e H 2 diminuito le loro espressioni ( Fig. 5h ), suggerendo che H 2 regola questi geni attraverso la via NFAT.
Al contrario, l’attivazione di CREB mediata da AAPH non è stata osservata ( Figura 5 supplementare ) in questa linea cellulare in coltura, indipendentemente dalla stimolazione del Ca 2+ cellulare . In particolare, l’espressione del gene bersaglio CREB NFKB2 (gene NF-κB, subunità 2) non è stata influenzata da AAPH ( Fig. 5i ) e l’espressione di HMOX1 (gene dell’eme ossigenasi 1), un fattore nucleare correlato al fattore E2 il fattore 2 (Nrf2)-target, è stato leggermente ma non significativamente aumentato da H 2 ( Fig. 5i ). Questo risultato era coerente con quelli di uno studio precedente 26 . Pertanto, la via NFAT potrebbe contribuire principalmente alla risposta trascrizionale H 2- dipendente indotta dai radicali liberi almeno nelle cellule THP-1.
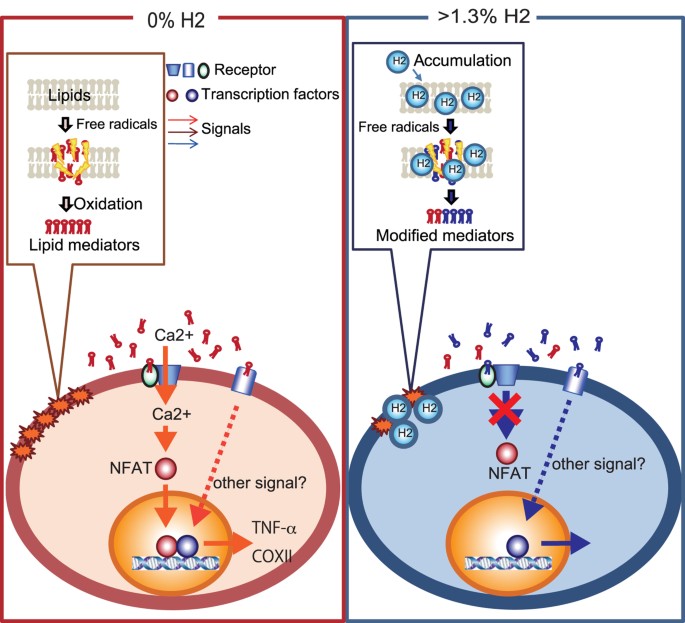
Nel loro insieme, queste risposte cellulari, almeno in parte, sono in accordo con quelle ottenute utilizzando i prodotti H2 – dipendenti in vitro delle specie OxPAPC ( Figg. 3 , 4 ). Pertanto, abbiamo proposto un modello in cui l’H2 è collegato alla modulazione della trasduzione del segnale del Ca2 + e della via NFAT tramite specie di fosfolipidi ossidati, come illustrato in Fig. 6 .
Un modello del percorso proposto.
Quando l’ossidazione della catena dei radicali liberi genera mediatori fosfolipidici ossidati, viene indotta la segnalazione del Ca 2+ , seguita dall’attivazione della calcineurina e dalla successiva induzione della via NFAT. D’altra parte, l’H 2 modifica la produzione di fosfolipidi ossidati modulando le reazioni a catena dei radicali liberi. I presunti fosfolipidi ossidati sembrano funzionare come antagonisti e portare ad un declino nella segnalazione del Ca 2+ .
Discussione
Sebbene gli effetti biologici dell’H 2 siano stati valutati in più di 300 studi sugli animali e 10 analisi cliniche sull’uomo 6 , 7 , i meccanismi molecolari attraverso i quali l’H 2 a basse concentrazioni esercita i suoi molteplici effetti sulla trasduzione del segnale sono rimasti sconosciuti. Pertanto, in questo studio, abbiamo mirato a esaminare come l’H 2 regola le vie di trasduzione del segnale che mediano l’espressione genica. I nostri risultati suggeriscono che basse concentrazioni di H 2 modulano la trasduzione del segnale di Ca 2+ e regolano l’espressione genica modificando la produzione di specie fosfolipidiche ossidate. Quindi, questi dati forniscono importanti informazioni su uno dei meccanismi molecolari mediante i quali l’H 2 media l’espressione genica.
L’H2 può essere ingerito tramite diversi metodi. Il consumo di acqua infusa con H 2 (acqua H 2 ) si è dimostrato efficace nel trattamento di varie malattie in modelli animali e nell’uomo 6 , 7 ; tuttavia, l’H2 può essere infuso fino a soli 0,8 mM sotto pressione atmosferica e bere acqua satura di H2 fornisce una concentrazione ematica fino a soli ~10 μM, con un breve tempo di permanenza nel corpo 11,27 . Inoltre, l’inalazione di gas H 2 all’1%–4% (v/v) si è dimostrata efficace, raggiungendo concentrazioni di 8–32 μM H 2 nel sangue 1 , 4 , 5 . Tuttavia, l’avvio dei segnali cellulari da parte di queste basse concentrazioni di H 2 può essere difficile da spiegare perché l’H 2 dovrebbe essere troppo inerte per reagire con la maggior parte delle molecole. Per attivare l’H 2 per la reazione con le altre molecole, deve essere presente un livello sufficiente di un presunto catalizzatore; tuttavia, è improbabile che un tale presunto catalizzatore sia abbondante all’interno delle cellule. Inoltre, l’H 2 è molto piccolo ed è improbabile che si leghi ad un presunto recettore che leghi l’H 2 perché ci si aspetta che la sua fluttuazione intramolecolare porti ad instabilità in termini di termodinamica, come discusso in precedenza 28 . Pertanto, non era noto come basse concentrazioni di H 2 regolassero la trasduzione del segnale e l’espressione genica.
Poiché l’aumento dello stress ossidativo che coinvolge ·OH innesca reazioni a catena dei radicali liberi, abbiamo ipotizzato che i mediatori prodotti chimicamente derivati dai fosfolipidi potrebbero contribuire a varie condizioni patogene. Nel presente studio, abbiamo verificato che una piccola quantità di H 2 (fino all’1,3%) influenza la perossidazione lipidica dipendente dai radicali liberi, da cui dovrebbero derivare i mediatori lipidici ossidati 22 .
Generalmente, l’H 2 idrogena gli acidi grassi insaturi a temperature più elevate con un catalizzatore di palladio. Per quanto ne sappiamo, nessuno studio ha esaminato l’idrogenazione dipendente dall’autossidazione a circa l’1% (v/v) di gas H 2 a 37 °C senza alcun catalizzatore. Sebbene si pensasse che l’H 2 fosse inerte in assenza di un catalizzatore a temperatura corporea, in questo studio abbiamo dimostrato che circa l’1% (v/v) di H 2 sopprime l’autossidazione di un acido grasso insaturo in un sistema chimicamente puro; quindi, i nostri dati hanno fornito approfondimenti sulle attività biologiche dell’H 2 .
Ci sono due possibilità: gli effetti delle specie di fosfolipidi ossidati sulla segnalazione del Ca 2+ possono essere spiegati dalla diminuzione dei livelli di un presunto agonista che induce la segnalazione del Ca 2+ o da un aumento dei livelli di un presunto antagonista che disturba la segnalazione del Ca 2+ . Sebbene non siamo riusciti a identificare queste specie in questo studio, è probabile che l’H 2 abbia modificato la produzione di forme ridotte di specie di fosfolipidi ossidati durante le reazioni a catena dei radicali liberi in base ai seguenti risultati precedenti: POVPC è un mediatore fosfolipidico bioattivo prodotto mediante sostanze chimiche È stato dimostrato che l’ossidazione del PAPC e la forma ridotta del POPVC funzionano come antagonisti della trasduzione del segnale18 . Pertanto, è possibile che durante una reazione a catena dei radicali liberi lipidici, l’H 2 contribuisca alla generazione di una o più forme ridotte che funzionano come uno o più antagonisti. Pertanto, abbiamo proposto un modello ipotetico in cui l’H2 è collegato alla modulazione della trasduzione del segnale del Ca2 + e della via NFAT tramite specie di fosfolipidi ossidati come illustrato in Fig. 6 .
Studi precedenti hanno dimostrato che l’1%–4% era efficace nell’inalare il gas H 2 in vari esperimenti sugli animali 1 , 3 , 4 , 29 , 30 , 31 . Poiché è disponibile una miscela di gas contenente 1,3% H 2 , 30% O 2 e 68,7% N 2 , è stato necessario indagare gli effetti di circa l’1,3% in ulteriori studi, compresi quelli clinici 5 . Le concentrazioni efficaci di gas H 2 erano approssimativamente costanti durante questo studio ( Fig. 2 , 3 , 4 , 5 ).
Nel presente studio non è stato identificato alcun recettore coinvolto nella segnalazione del Ca 2+ ; tuttavia, uno studio precedente ha dimostrato che alcuni mediatori fosfolipidici ossidati chimicamente, come 9-HODE e 11-HETE, potrebbero legarsi a un recettore accoppiato a proteine G (G2A) per indurre la segnalazione di Ca 2+ 17 . Pertanto, i presunti mediatori o antagonisti dei fosfolipidi ossidati potrebbero legarsi ai recettori accoppiati alle proteine G per modulare la trasduzione del segnale.
Oltre al ruolo antiossidante dell’H 2 , è stato dimostrato che funziona come immunosoppressore nel trapianto allotrapianto 32 . Questo effetto immunosoppressore può essere spiegato con la soppressione dell’attivazione di NFAT poiché un immunosoppressore come CsA e tacrolimus (FK506) agisce attraverso l’inattivazione della calcineurina. Poiché le citochine proinfiammatorie sono regolate da meccanismi NFAT-dipendenti 20 , gli effetti antinfiammatori dell’H 2 possono essere spiegati dalla soppressione di NFAT. Inoltre, gli effetti antiallergici dell’H 2 possono essere spiegati dalla diminuzione del segnale Ca 2+ /NFAT 33 .
Un numero considerevole delle molteplici funzioni di H 2 , come mostrato da studi precedenti, potrebbe essere spiegato dal legame tra H 2 e NFAT a causa delle numerose funzioni multiple di NFAT 20 , 34 . Ad esempio, la diminuzione dell’espressione dell’ossido nitrico sintasi inducibile (iNOS) da parte dell’H 2 35 può essere spiegata dall’inattivazione di NFAT 36 . La soppressione della differenziazione degli osteoclasti 37 e il miglioramento dell’ipertensione 38 , 39 da parte dell’H 2 potrebbero coinvolgere la via NFAT 40 , 41 . Inoltre, la ridotta espressione di prodotti genici attraverso una via NFAT-dipendente potrebbe essere coinvolta nella degenerazione indotta dall’α-sinucleina dei neuroni dopaminergici del mesencefalo nella malattia di Parkinson42 . Questo percorso NFAT-dipendente potrebbe spiegare gli effetti benefici dell’H 2 in questi pazienti 8 . Sono necessari ulteriori studi per chiarire i meccanismi attraverso i quali l’H 2 esercita molteplici funzioni in termini di coinvolgimento della via NFAT.
In sintesi, in questo studio, abbiamo studiato il legame tra H 2 , fosfolipidi ossidati e segnalazione di Ca 2+ . Sono necessari ulteriori studi per identificare il/i mediatore/i bioattivo/i H2 – dipendente/i. I nostri dati hanno fornito importanti informazioni su uno dei meccanismi mediante i quali l’H 2 regola la trasduzione del segnale e l’espressione genica; tuttavia, l’H 2 potrebbe contribuire anche ad altri tipi di vie di segnalazione perché l’H 2 regola molti geni appartenenti a varie vie di segnalazione. Si prevede che una comprensione più dettagliata dei meccanismi molecolari della trasduzione del segnale H2 – dipendente e dell’espressione genica faciliterà l’applicazione dell’H2 in un’ampia gamma di applicazioni mediche.
Metodi
Misurazione di H2
I gas contenenti H 2 sono stati preparati miscelando H 2 , O 2 , N 2 e CO 2 a varie concentrazioni da ciascuna bombola di gas dotata di un flussometro. La concentrazione di H2 nella miscela di gas o aria è stata testata in ciascun esperimento utilizzando la gascromatografia (Breath Gas Analyser, modello TGA2000; TERAMECS Co. Ltd., Kyoto, Giappone) come descritto in precedenza 1 . Per la misurazione di H2 nel solvente, l’H2 è stato trasferito alla fase aerea in un sacchetto di alluminio chiuso e la concentrazione di H2 è stata misurata utilizzando la gascromatografia come descritto in precedenza 1 . L’alluminio utilizzato nella borsa è stato ricoperto con una pellicola di plastica per evitare qualsiasi influenza dell’alluminio.
Autossidazione del film di acido linoleico
L’acido linoleico e (±) 9-HODE sono stati acquistati rispettivamente da Nacalai Tesque (Kyoto, Giappone) e CAY (MI, USA). L’acido linoleico è stato sciolto in cicloesano a 16 mM e 2 μL sono stati dispensati in ciascun tubo di vetro (ϕ10 × 50 mm) riempito con gas argon; è stato lasciato asciugare fino a formare una pellicola di acido linoleico sul fondo di un tubo di vetro. I tubi di vetro furono posti in un sacchetto di alluminio chiuso e il gas nel sacchetto fu completamente sostituito con la miscela di gas indicata, dove H 2 , O 2 e N 2 puri furono ottenuti da bombole separate. Il sacchetto è stato incubato a 37°C per 20 ore per l’autossidazione e 0,2 mL di cicloesano sono stati immediatamente aggiunti al tubo di vetro per ottenere acido linoleico perossidato 0,16 mM. La concentrazione del diene coniugato è stata stimata misurando l’assorbimento a 234 nm durante la scansione da 200 a 300 nm.
Autossidazione del PAPC puro nell’aria in assenza o presenza di H 2
Il PAPC puro sintetizzato chimicamente è stato acquistato da Avanti Polar Lipids (Alabaster, AL, USA). Il PAPC è stato autoossidato in aria come descritto in precedenza 43 . In breve, 0,5 mg di PAPC in 50 μL di cloroformio sono stati trasferiti in un tubo di vetro ϕ10 × 50 mm ed essiccati sotto un leggero flusso di azoto. Il residuo lipidico è stato lasciato autoossidare in aria con umidità del 100% a 25 °C in presenza o assenza delle concentrazioni indicate di gas H 2 in un sacchetto di alluminio chiuso per i periodi indicati e quindi sospeso in PBS ad una concentrazione di 0,5 mg /ml.
Stima di OxPAPC con Liperfluo
OxPAPC è stato analizzato in etanolo con Liperfluo come descritto in precedenza25 . Cinque minuti dopo l’aggiunta di OxPAPC a 1 μM di Liperfluo a temperatura ambiente, la fluorescenza è stata misurata utilizzando uno spettrofotometro a fluorescenza (RF-5300PC; Shimadzu Corporation, Kyoto, Giappone), dove le lunghezze d’onda di eccitazione ed emissione sono state impostate rispettivamente a 488 e 535 nm.
Misurazione della segnalazione del Ca 2+
Il Ca 2+ intracellulare nelle cellule THP-1 trattate con OxPAPC è stato misurato utilizzando un Calcium Kit-Fluo 4 (CS22; Dojindo, Kumamoto, Giappone) secondo il protocollo del produttore. In breve, le cellule THP-1 sono state lavate con PBS e incubate con Fluo 4-AM 4,5 μM in un mezzo di registrazione (HEPES 20 mM, NaCl 115 mM, KCl 5,4 mM, MgCl 2 0,8 mM , CaCl 2 1,8 mM, glucosio 13,8 mM) contenente 0,064% F-127 pluronico e probenecid 1,25 mM per 30 minuti a 37 °C. Le cellule sono state lavate con PBS e risospese in un mezzo di registrazione contenente probenecid 1,25 mM. Le cellule sono state seminate su piastre con fondo di vetro da 35 mm e quindi stimolate con 100 μg/mL di OxPAPC o H2 OxPAPC , seguite da 25 μM di ATP. I cambiamenti nella fluorescenza Fluo 4-AM sono stati monitorati utilizzando un microscopio confocale a scansione laser (FV1200; Olympus Corporation, Tokyo, Giappone). L’intensità di ciascun segnale fluorescente in 400 cellule è stata esaminata e giudicata positiva se era presente più del 30% del segnale ATP.
Il Ca 2+ intracellulare delle cellule THP-1 trattate con l’induttore di radicali liberi AAPH 23 è stato misurato mediante Fluo-3 (F-23915; Molecular Probes, Eugene, OR, USA). In breve, le cellule THP-1 sono state pre-incubate con 2 μM di Fluo 3-AM in HBSS contenente lo 0,02% di F-127 pluronico per 30 minuti a 37 °C, risospese in RPMI1640 (con il 10% di FBS) contenente 2,5 mM di probenecid, seminate in Piastre da 24 pozzetti e poi trattate con AAPH in presenza o assenza di H 2 . I cambiamenti nei segnali di fluorescenza Fluo-3 sono stati osservati utilizzando un microscopio confocale a scansione laser (FV1200; Olympus).
Analisi spettrometrica di massa e presentazione dei dati mediante mappe di calore
OxPAPC (disciolto in cloroformio a 2,5 mg/mL) è stato analizzato mediante spettrometria di massa con ionizzazione elettrospray (ESI-MS) utilizzando uno spettrometro di massa LTQ ORBITRAP XL (Thermo Fisher Scientific, San Jose, CA, USA) dotato di una guaina di azoto portata di gas di 40 AU a 300 °C. Il campione è stato infuso direttamente. L’intervallo di scansione era compreso tra 250 e 1000 m/z nella modalità di rilevamento degli ioni positivi. La tensione dello spray ionico è stata impostata su 4 kV. Le specie OxPAPC sono state identificate in base ai loro valori m/z e confermate utilizzando l’analisi spettrometrica di massa come descritto in precedenza 14 , 44 , 45 .
Sono stati eseguiti due esperimenti indipendenti. La media dei dati è stata utilizzata per la costruzione di una mappa termica e visualizzata in profili spettrometrici di massa. Nella mappa termica, le bande sono state organizzate in base alla massa molecolare da piccola a grande e la forza di ciascuna banda ottenuta da H 2 OxPAPC è stata confrontata con quelle di OxPAPC. Le bande rosse e verdi rappresentavano rispettivamente livelli aumentati e diminuiti rispetto a quelli di OxPAPC. Il display della spettrometria di massa indica la banda media di due esperimenti. Solo quando sono state rilevate bande da tutti e 10 gli esperimenti (due esperimenti allo 0%, 0,2%, 0,3%, 1,3% e 5% di H 2 ), queste sono state adottate.
Analisi completa dell’espressione genica
Le cellule THP-1 sono state esposte per 4 ore a PAPC o OxPAPC, H 2 [1,3%]OxPAPC e H 2 [5%]OxPAPC che erano state autoossidate per 3 giorni rispettivamente con 0%, 1,3% o 5% di H 2 . L’RNA totale è stato estratto utilizzando un RNeasy Mini Kit secondo il protocollo del produttore (Qiagen, Valencia, CA, USA) ed etichettato utilizzando un kit di etichettatura QuickAmp a basso input, One-Color (Agilent Technologies, Santa Clara, CA, USA). L’analisi dell’espressione genica è stata eseguita su campioni provenienti da tre esperimenti indipendenti utilizzando un microarray (SurePrint G3 Human GE 8 × 60 K v2 Microarray; Agilent Technologies). I dati grezzi del microarray sono stati depositati nel Gene Expression Omnibus (GEO; numero di accesso, GSE62434; http://www.ncbi.nlm.nih.gov/geo/query/acc.cgi?acc=GSE62434 ). I geni target CREB sono stati selezionati in base al database dei geni target CREB ( //natural.salk.edu/CREB/ ), mentre i geni target NFAT sono stati selezionati facendo riferimento a Medline, come elencato nella Tabella 1 supplementare . Le vie di trasduzione del segnale associate a ciascun gene sono state identificate secondo il KEGG Pathway Database ( http://www.genome.jp/kegg/pathway.html ).
PCR quantitativa in tempo reale
Per quantificare i livelli di mRNA, la PCR quantitativa in tempo reale è stata eseguita utilizzando TaqMan Probe e Premix Ex Taq (Probe qPCR; TaKaRa Bio Inc., Shiga, Giappone) in un TaKaRa PCR Thermal Cycler Dice TP960 (TaKaRa Bio) secondo i protocolli del produttore . Per normalizzare i livelli di espressione dell’mRNA, è stata utilizzata la gliceraldeide 3-fosfato deidrogenasi (GAPDH) come controllo interno endogeno. I primer e le sonde utilizzate per la RT-PCR sono descritti nella Tabella 2.
ELISA ( saggio immunoassorbente legato all’enzima) Le cellule HAEC e THP-1 sono state trattate con PAPC, OxPAPC o H2OxPAPC per 22 ore. Il contenuto di IL-8 (HAEC) e TNF-α (THP-1) nei terreni di coltura è stato determinato utilizzando il kit ELISA Quantikine CXCL8/IL-8 umano (R&D Systems, Minneapolis, MN, USA) e il kit ELISA Quantikine TNF-α umano Kit (R&D Systems, Minneapolis, MN, USA), rispettivamente, secondo il protocollo del produttore.
Rilevazione della perossidazione lipidica nelle cellule in coltura
Le cellule THP-1 (1 × 105 cellule /mL) sono state colorate con 5 μM di Liperfluo 25 per 30 minuti e poi trattate con 10 mM di AAPH 23 per 4,5 ore in assenza o presenza delle concentrazioni indicate di gas H 2 in un vaso chiuso. Le cellule sono state analizzate utilizzando un citometro a flusso Cell Lab Quanta (Beckman Coulter, Miami, FL, USA).
Rilevazione della traslocazione di NFAT nel nucleo mediante immunofluorescenza
Le cellule THP-1 (1 × 10 5 cellule/mL) sono state trattate con OxPAPC (0,1 mg/mL) o H 2 [2,5%]OxPAPC (0,1 mg/mL) per 1,5 ore, che sono state utilizzate per il Ca 2+ il test di segnalazione e quindi la traslocazione di NFAT è stata determinata utilizzando l’immunofluorescenza come segue. Le cellule sono state fissate per 20 minuti con formalina tamponata neutra al 10% (3,8% formaldeide) e quindi permeabilizzate con Triton X-100 allo 0,2% in soluzione salina tamponata con Tris (TBS-T) per 10 minuti. Dopo che le cellule sono state lavate e bloccate con latte scremato al 5% in TBS-T, sono state incubate con anticorpi anti-NFAT1 (diluizione 1:100; 25A10.D6.D2; Abcam, Cambridge, MA, USA) durante la notte a 4 °C. , seguito da incubazione con anticorpi anti-topo coniugati con Alexa Fluor 488 (diluizione 1:400; A-11029; Life Technologies, Carlsbad, CA, USA) per 1 ora a 25 °C. Le cellule sono state controcolorate con Hoechst 33342. L’immunofluorescenza è stata osservata utilizzando un microscopio confocale a scansione laser (FV1200; Olympus).
Le cellule THP-1 (1 × 105 cellule /ml) sono state trattate con AAPH 10 mM per 3 ore in assenza o presenza delle concentrazioni indicate di H 2 e la traslocazione di NFAT è stata studiata utilizzando l’immunofluorescenza come descritto sopra.
Coltura cellulare
Le cellule THP-1 (ATCC) sono state coltivate in RPMI1640 contenente il 10% di FBS. Le cellule endoteliali aortiche umane (HAEC) sono state ottenute da Lonza e mantenute nel mezzo di crescita delle cellule endoteliali [mezzo EBM + integratori di crescita+FCS (Lonza)]. Le cellule sono state coltivate a 37 °C in un’atmosfera umidificata al 5% di CO2 e sono state utilizzate per gli esperimenti dal passaggio 4 all’8.
analisi statistica
Le differenze statistiche tra i gruppi sono state valutate mediante analisi della varianza a una via (ANOVA) con analisi post hoc di Tukey-Kramer, salvo diversa indicazione. Le analisi statistiche sono state eseguite con il software IBM SPSS21. I risultati sono stati considerati significativi con P <0,05. Quando 0,01 < P < 0,05, sono stati annotati i valori P effettivi . I dati sono presentati come medie ± deviazioni standard.
Informazioni aggiuntive
Come citare questo articolo : Iuchi, K. et al. L’idrogeno molecolare regola l’espressione genica modificando la generazione dipendente dalla reazione a catena dei radicali liberi di mediatori fosfolipidici ossidati. Sci. Rep. 6 , 18971; doi: 10.1038/srep18971 (2016).